Kompetenzen Zellphysiologie und Zell-Engineering
Unsere anwendungsorientierte Forschungsthemen konzentrieren sich inhaltlich auf die Gebiete der Stammzellforschung, zellbasierten Testsysteme, Zelldifferenzierung, Glykobiologie und der molekularen Zellbiologie (Genetic Engineering).
Vorhandene wissenschaftliche Kompetenz der Fachgruppe Zellphysiologie & Zell-Engineering sind:
Entwicklung zellbasierter Testsysteme
In Zusammenarbeit mit Projektpartnern werden in der Gruppe der Zellphysiologie und Zellengineering eine Vielzahl eigens entwickelte zellbasierte Testsysteme und Standardmethoden eingesetzt. Folgend sind einige der Methoden aufgeführt.
Caco-2 Permeabilitätstest
Caco-2 Zellen (humane Colon Adenocarcinoma) können dazu verwendet werden die Transport-und Aufnahmeeigenschaften des Dünndarmes zu imitieren. Der Permeabilitätstest mit dieser Zelllinie ist eine Standardmethode, um Drogen und Substanzen auf ihre Aufnahmeeigenschaften in vitro zu untersuchen. Bei einer Kultivierung von drei Wochen auf permeable Membranen differenzieren Caco-2 Zellen und bilden eine Reihe von Transporterproteinen in ihrer Zellmembran aus. Einer der wichtigsten Membranproteine ist unter anderem P-gp (P-Glycoprotein), welcher in der Lage ist fremde Substanzen aktiv aus der Zelle zu pumpen. Dies kann dazu führen, dass bei eingesetzten Medikamenten ein verminderter Effekt auftritt. Die permeable Membran unterteilt das Gefäss in zwei Kompatimente. Dadurch können zwei Transportrichtungen unterschieden werden. Durch Zugabe der zu testenden Substanz zu einem Kompartiment kann der Transport bestimmt werden indem nach einer festgelegten Zeit im anderen Kompartiment die Substanzkonzentration bestimmt wird. Die Bestimmung des apikal-basolateralen (A → B) und basolateral-apikalen (B → A) Transportes erlaubt es den Nettofluss des Transportes zu errechnen.
Zytotoxizitätsassay
Eine Vielzahl von Produkten, wie Medizinprodukte, Arzneimittel oder deren Ausgangmaterialien und neuer innovativer Materialien, werden zum Ausschluss biologischer Risiken für Mensch und Tier auf ihrer Toxizität geprüft. Hierbei ist vor allem die Biokompatibilität von Bedeutung, welche durch unsere Fachgruppe der Zellphysiologie und Zellengineering mittels in-vitro-Prüfungen auf Zytotoxizität getestet wird.
Die Beurteilung der In-vitro-Zytotoxizität an Zellkulturen wird mit Hilfe von Extrakten des zu testenden Materials ermittelt. Dabei wird das zu testende Material vorbereitet und anhand einer standardisierten Zytotoxyzitätsprüfung auf einer der Zelllinien getestet. Mit Hilfe eines colorimetrischen Tests (MTT) wird im Anschluss die Zellproliferation quantifiziert. Die schädigende Wirkung der Prüfsubstanzen wird anhand der Beeinträchtigung der Zellproliferation nach einer Dosis-Wirkungskurve (dose-response) beurteilt und nach einer statistischen Auswertung der EC50 - oder IC50-Wert bestimmt. Die Prüfergebnisse werden abschliessend in einem Bericht zusammengefasst.
Osteoklastendifferenzierung
Osteoklasten sind Knochenabbauenden Zellen des Körpers, welche zusammen mit den Knochenaufbauenden Zellen (Osteoblasten) dafür sorgen, dass sich der Knochen ständig erneuern kann. Ein Gleichgewicht muss zwischen den auf-und abbauenden Systemen bestehen. Häufig tritt bei Krebspatienten bei Metastasen im Knochen ein Ungleichgewicht auf indem die Osteoklastogenese (Entstehung von Osteoklasten) vermehrt gefördert wird. In unserem Labor untersuchen wir dazu mögliche Hemmstoffe der Osteoklastogenese. Dazu setzen wir in unserem Labor ein eigens entwickeltes Testsystem ein, welches uns erlaubt die Osteoklastogene quantitative zu erfassen. Herkömmliche Bestimmungen erlaubten nur eine sehr aufwendige bzw. beschränkte Quantifizierung der Osteoklastogene.
RAW 264.7 fusion to osteoclasts

Herstellung neuer Antikörper gegen komplexe Proteine
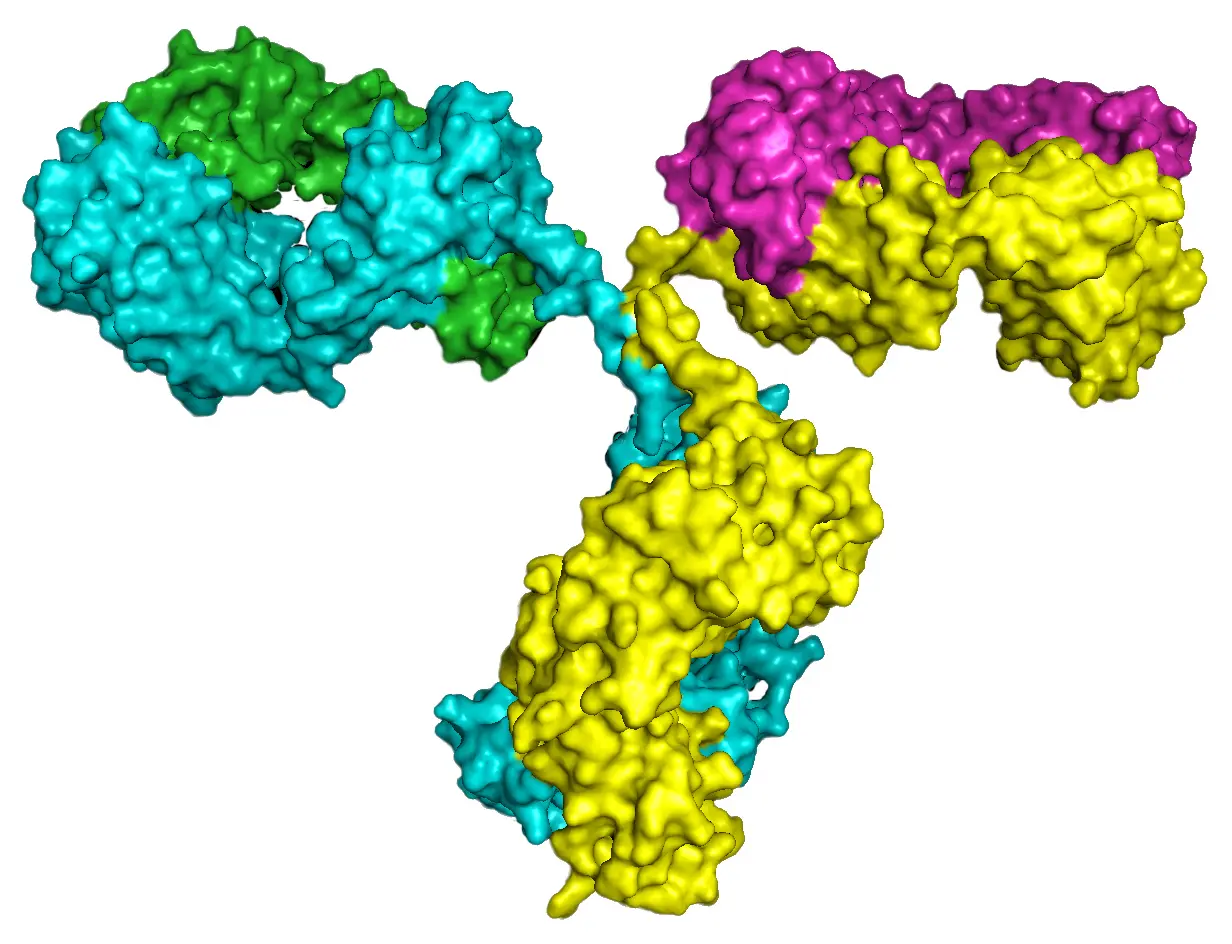
Viele klinisch relevante Proteine wie z.B. G-Protein gekoppelte Rezeptoren oder Ionenkanäle haben eine komplexe Struktur mit mehreren Transmembrandomänen. Deshalb kommt eine Reinigung dieser Proteine als Ausgangsprodukt zur Herstellung von spezifischen Antikörpern nicht in Frage. Peptide repräsentieren nur eine kleine Fraktion des gesamten Proteins und sind nicht in der nativen Konformation des Proteins, was oft zu Antikörper mit geringerer Affinität führt. Unsere Methode basiert darauf, dass das gesamte menschliche Protein in seiner nativen Konformation als Antigen für die Herstellung hoch-affiner Antikörper verwendet wird. Zusätzlich werden Hasen für die Immunisierung verwendet, weil bekannt ist, dass Hasen generell Antikörper mit höherer Affinität produzieren als Mäuse. Dies hilft zusätzlich um exzellente Antikörper zu generieren.
Primärkulturen und Herstellung von Zelllinien

Reporter Gene? Rekombinante Proteinexpression? Antigen Expression? Fluoreszente Färbung intrazellulärer Organellen? Wir helfen Ihnen die richtigen Zellen für die richtige Anwendung herzustellen.
Unsere Forschungsgruppe ist spezialisiert auf die genetische Veränderung von Zellen. Wir unterstützen Firmen in der Biotechnologie und Pharma Branche bei der Etablierung oder Verbesserung von spezialisierten Zellen für ihre spezifischen Anwendungen und Prozesse. Unsere Expertise beinhaltet die Identifikation, Isolation und/oder das immortalisieren von primären Zellen. Primäre Zellen oder auch schon etablierte Zelllinien können zusätzlich verändert werden, um ihre Eigenschaften zu modifizieren und zu verbessern oder für neue Anwendungen anzupassen. Mit Hilfe dieser Technologie können wir neue Zell-basierende Assays etablieren, rekombinante Protein Expression in Säugerzellen steuern oder neue Zellen entwickeln mit neuen Eigenschaften.
Induzierte pluripotente Stammzellen (iPSCs)
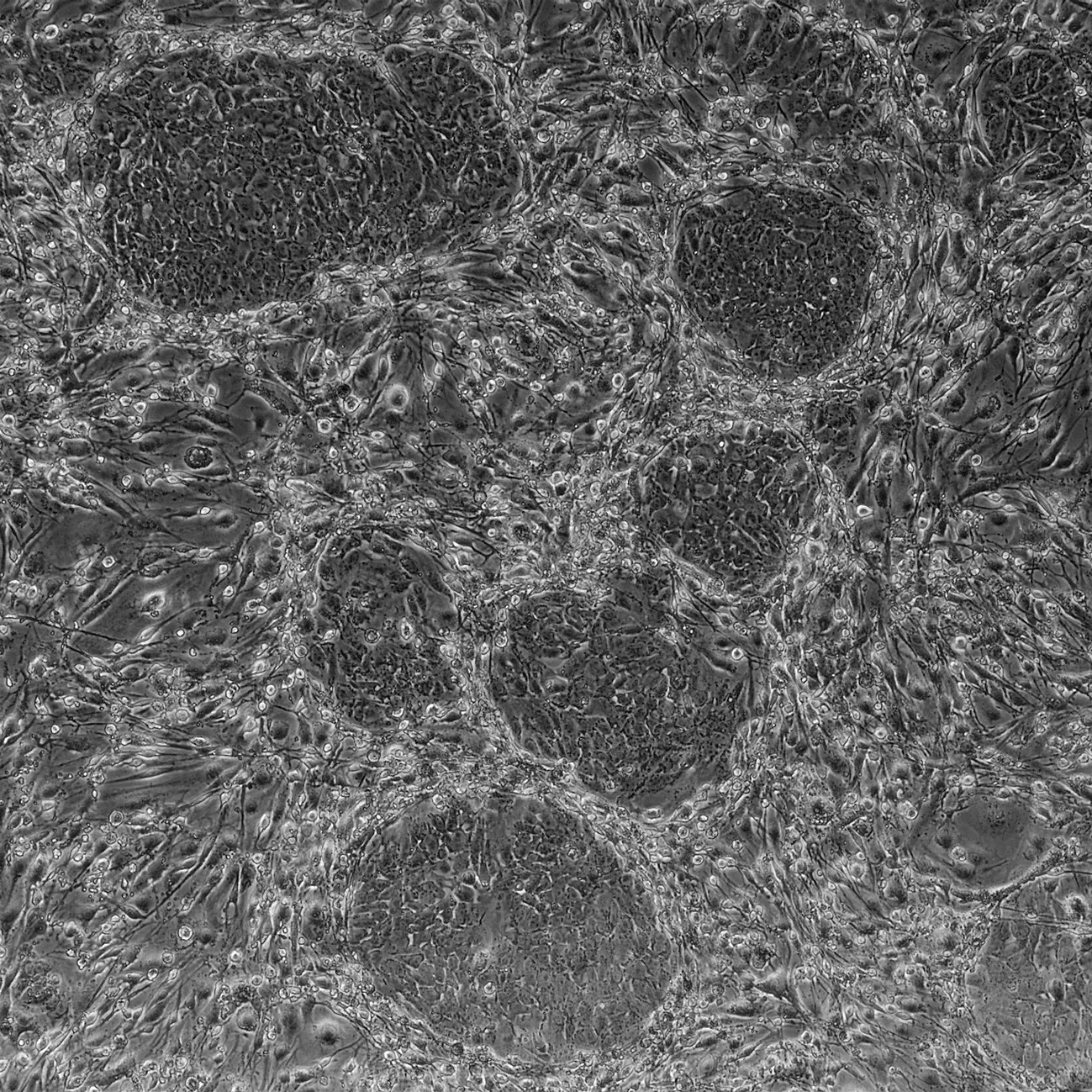
Pluripotente Stammzellen haben sowohl eine essentielle Rolle in der Entwicklung eines Embryos als auch in der Homeostase von Geweben und Organen während des ganzen Lebens. Das Verständnis der Biologie von Stammzellen ermöglicht der Biotech Industrie extrem innovative Projekte mit sehr grossem ökonomischen Potential. Experten im Bereich der regenerativen Medizin untersuchen zur Zeit Möglichkeiten mit Hilfe von Stammzellen Organe oder Teile davon in vitro zu züchten. Spezialisten in der kosmetischen Industrie sind sehr am Potenzial von Stammzellen interessiert, um eine Verjüngung und Regeneration der Haut zu ermöglichen. Die Arbeit mit Stammzellen ist jedoch sehr schwierig, weil sie einerseits sehr selten sind im adulten Körper und ethische wie auch gesetzliche Richtlinien die Arbeit mit menschlichen embryonalen Zellen verbieten.
Ein möglicher Ausweg wurde 2007 aufgezeigt, als Takahashi et al. zeigen konnte, dass sie aus gewöhnlichen Hautzellen pluripotente Stammzellen generieren konnten. Diese induzierten pluripotenten Stammzellen (iPSC, induced pluripotent stem cells) konnten, wie normale embryonale Stammzellen, sich zu lebensfähigen Mäusen entwickeln.
Wir haben nun die Technologie zur Herstellung von menschlichen iPSCs in unserem Labor etabliert, um das Potential der iPSCs für die biotechnologische Industrie auszuschöpfen. Wir können somit unseren industriellen Partnern behilflich sein Anwendungen der Stammzell-Biologie zu entwickeln in den Bereichen wie:
- Testsysteme basierend auf Stammzellen
- Kontinuierlicher Nachschub von spezialisierten Zellarten durch gezielte Differenzierung von iPSCs
- Identifikation und Herstellung von aktiven Substanzen von iPSCs
Rekombinante Proteinexpression und Herstellung der dazu benötigten Zelllinien
Proteine werden heutzutage meist rekombinant in geeigneten Organismen wie z.B. E.coli oder verschiedene Hefearten, bis hin zu Zelllinien von Insekten- oder Säugerzellen produziert.
Wir stellen verschiedene Zelllinien (Säugetierzellen) her, welche die DNA der gewünschten Proteine stabil ins Genom integriert haben und diese meist ins Medium sekretieren. Sollte es sich bei dem Protein um ein einfaches Membranprotein oder ein intrazelluläres Protein handeln, können wir die Sequenz so verändern, dass es zur einfacheren Reinigung, von den Zellen sekretiert wird. Um die Produktionsrate zu steigern, optimieren wir jeweils die Codonauswahl des Gens für die verwendete Zelllinie. Bei unseren Epo (human) produzierenden CHO-easy Zellen wurde die Codons der DNA z.B. für die Produktion in CHO-Zellen optimiert.
Die Proteinexpression findet im kleinen Massstab in unterschiedlichen Kultivierungsgefässen von Well-Platten bis Spinner-Flaschen statt. Dabei verwenden wir für jede Zelllinie das passende Medium und kultivieren die Zellen unter optimalen Bedingungen.
Mit biochemischen Methoden werden die produzierten Proteine bei Bedarf aufgereinigt und auf ihre Qualität und Quantität getestet.
Molekulare Mechanismen der Zellbiologie für Biotechnologische Anwendungen
Die molekularen Mechanismen der Zellphysiologie sind oft die Grundlage für das Verständnis von essentiellen Abläufen in der industriellen Biotechnologie. Somit sind die Kenntnisse der funktionellen Wechselwirkungen innerhalb der Zellen und zwischen den Zellen die Grundlage für die Optimierung biotechnologischer Prozesse oder die Erzeugung von Produkten. Beispiele hierfür sind die Veränderung eines intrazellulären oder Membranproteins damit es von den Zellen sekretiert wird und somit einfacher gereinigt werden kann oder Veränderung der intrazellulären Lokalisation von Enzymen um deren Aktivität z.B. als Membranprotein an der Plasmamembran von speziellen Zellen zu nutzen oder die Verhinderung von schlechter und potentiell gefährlicher Glykosylierung (Aufnahme der Proteine von dendritischen Zellen und Makrophagen aufgrund der Glykosylierung) von Proteinen, die als Medikamente eingesetzt werden.
Subzelluläres Drug Delivery
Viele Zielstrukturen von Medikamenten sind innerhalb der Zellen in spezifischen Organellen lokalisiert. Jedoch werden die meisten Medikamente systemisch verabreicht und verteilen sich im ganzen Körper ohne eine spezifische Aufnahme in die Zellen und innerhalb der Zellen ohne spezifischen Transport zur Zielstruktur. Solch ein spezifischer Transport zur intrazellulären Zielstruktur würde es erlauben die effektive Konzentration des Medikaments drastisch zu reduzieren, was Nebenwirkungen aufgrund von Interaktionen des Medikamentes mit anderen Strukturen vermindern oder gar eliminieren würde. Deshalb ist die pharmazeutische Industrie sehr an solchen subzellulären Drug Delivery Systemen interessiert. Da wir seit mehr als 20 Jahren auf dem Gebiet des intrazellulären Proteintransportes arbeiten, wollen wir nun diese Erfahrung in einer engen Zusammenarbeit kombinieren mit der Fachgruppe Pharmazeutische Technologie von Prof. Dr. Vera Luginbühl, welche eine enorme Erfahrung hat auf dem Gebiet Drug Delivery. In einem ersten Schritt wollen wir ein Modellsystem entwickeln für den Transport von Medikamenten (Statine) ins endoplasmatische Retikulum mit der HMG-CoA Reduktase als Zielstruktur.
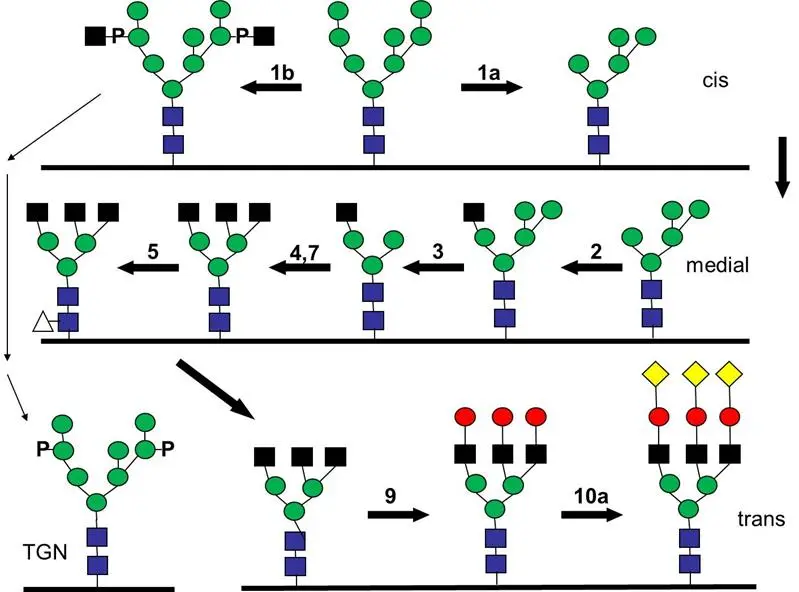
Glykobiologie und posttranslationale Proteinmodifikation
Projekte im Themenbereich Glykobiologie befassen sich sowohl mit dem intrazellulären Transport und der korrekten Lokalisation von Glykosyltransferasen als auch deren Enzymaktivität. Die genaue Kenntnis der Transportwege ermöglicht eine Manipulation der Lokalisation der Enzyme für biotechnologische Zwecke (z.B. Sekretion der Enzyme um eine einfachere Reinigung zu ermöglichen). Untersucht wird auch der Effekt unterschiedlicher Glykosylierung von Biosimilars (Generika eines Biopharmazeutikums, meist ein Protein). Bei der Produktion von rekombinanten Proteinen kann die Glykosylierung, als Qualitätsmerkmal der Proteine, von Hersteller zu Hersteller aber auch von Batch zu Batch sehr variabel sein. Dies kann nicht nur Unterschiede bei der Aktivität zur Folge haben, sondern birgt auch die potentielle Gefahr, dass das Immunsystem Antikörper gegen diese als Medikamente eingesetzte Proteine entwickelt, was sie aus therapeutischer Sicht im besten Fall nutzlos macht aber leider auch die Gefahr einer Autoimmunreaktion birgt.
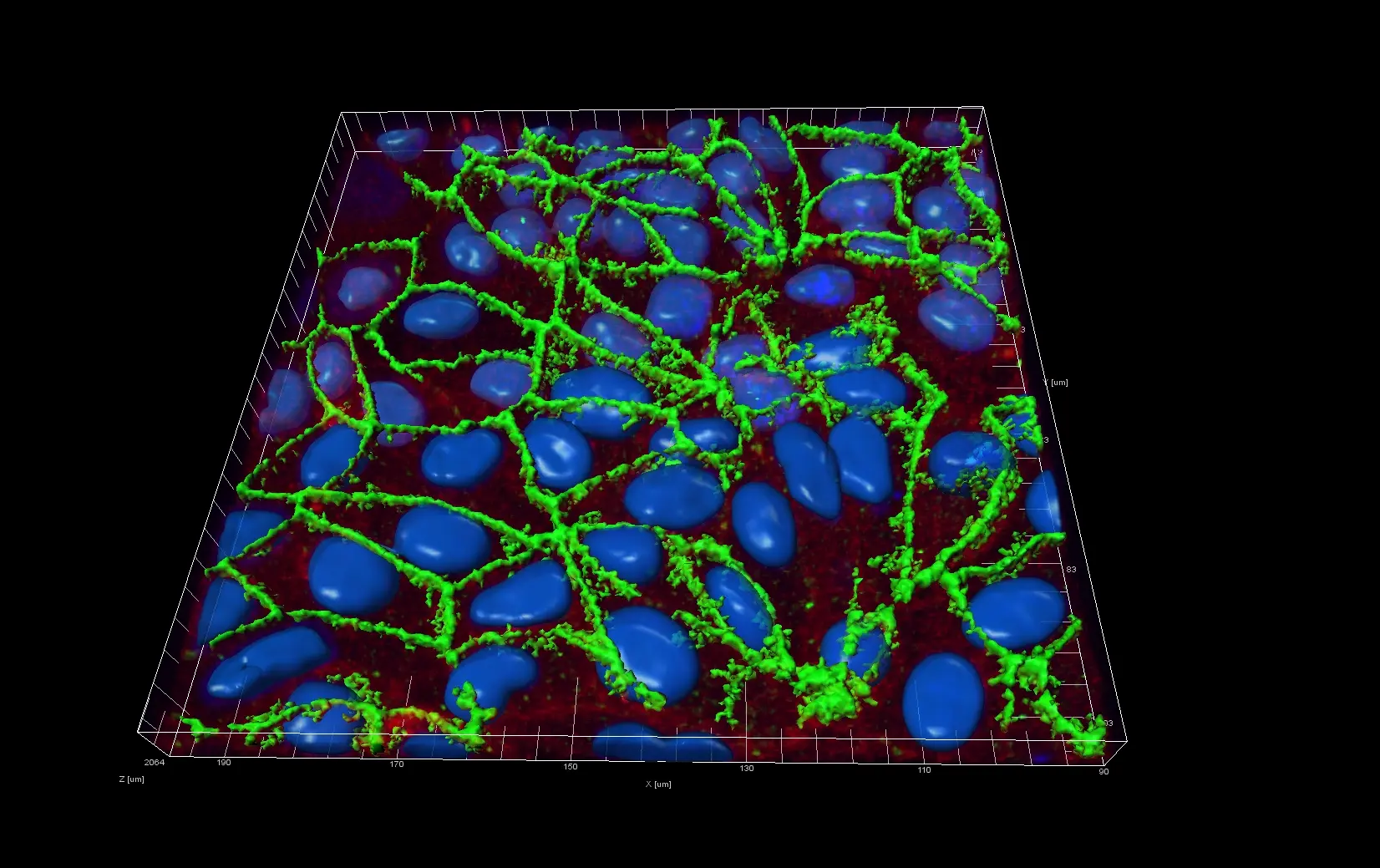
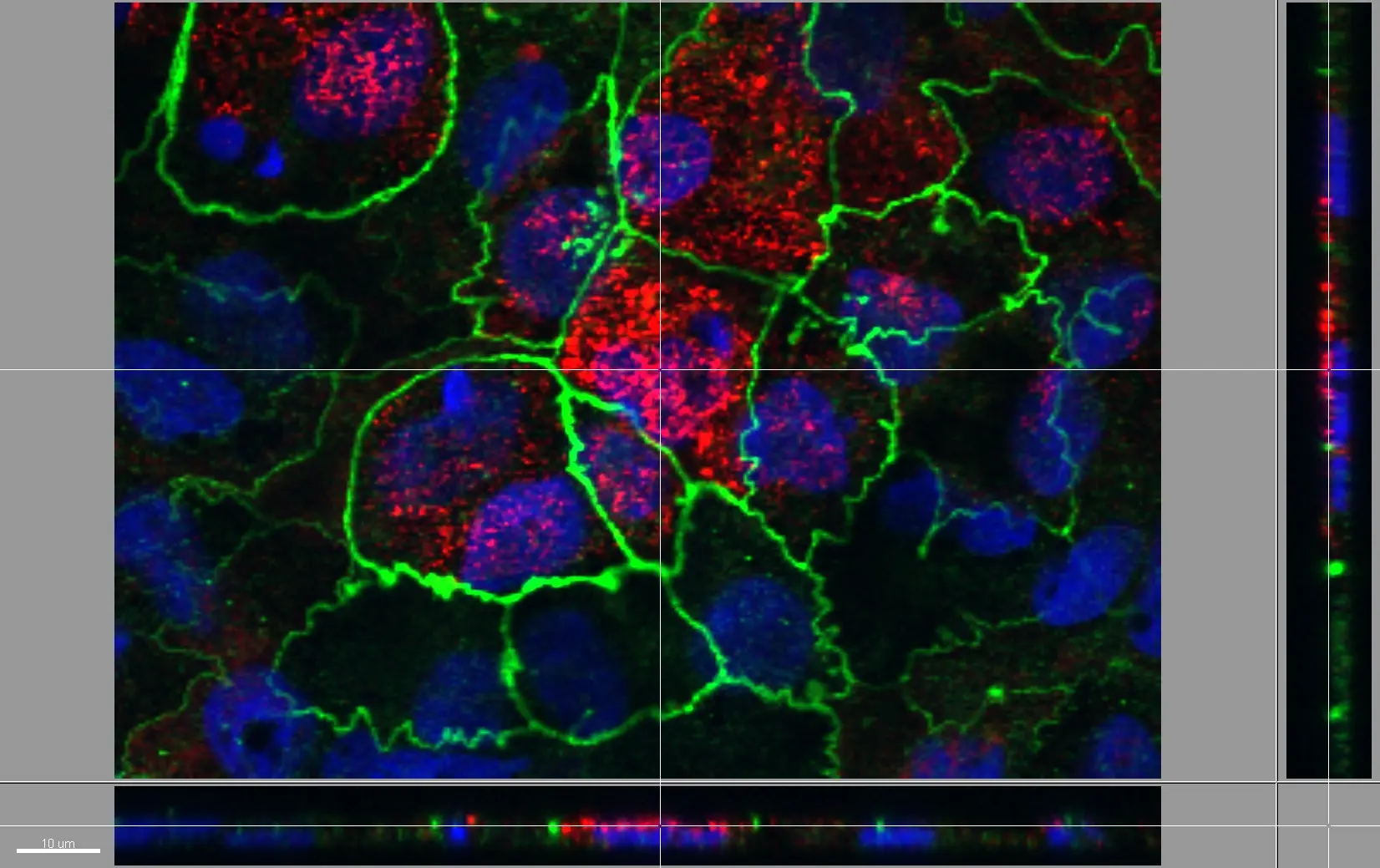
Live Cell Imaging

Das konfokale Laser Mikroskop hat im Gegensatz zum normalen Lichtmikroskop einen Punkt im Präparat welcher sich in der Fokusebene befindet, im Strahlengang im Inneren des Gerätes nochmals zu einem Punkt fokussiert. Da sich an genau dieser Stelle eine sehr kleine Lochblende befindet wird somit fast nur das Licht der Fluoreszenz durch gelassen, welche sich im Präparat in der Fokusebene befindet und Fluoreszenz ausserhalb der Fokusebene wird blockiert. Zusätzlich wird im Gegensatz zur normalen Fluoreszenzmikroskopie bei der konfokalen Laser Mikroskopie das Präparat nicht von einem Lichtstrahl beleuchtet, sondern eine möglichst dünne Schicht (genau im Fokus des Objektives) wird zur Fluoreszenz angeregt, was mit Hilfe der monochromatischen Eigenschaft von Laser Licht möglich ist. Die Energie des Laserstrahls wird auf einen Punkt fokussiert und die Fluoreszenz wird daher hauptsächlich an diesem Punkt innerhalb der Schicht angeregt und so die Anregung von Fluoreszenz in den Ebenen ober- und unterhalb der Fokusebene minimiert. Diese beiden Eigenschaften des konfokalen Laser Mikroskops ermöglichen eine extrem gute Qualität der Bilder und es ist sogar möglich einzelne Schichten aufzunehmen und diese zu einem 3D Bild zusammen zu setzen.
Die ZHAW besitzt ein FV 1000 von Olympus welches zusätzlich mit einer ‚live cell imaging‘ Kammer ausgerüstet ist. Damit können wir in der Kammer optimale Wachstumsbedingungen erzeugen und die Zellen in einer CO2 Atmosphäre bei 37°C über mehrere Tage hinweg kultivieren und gleichzeitig die Vorgänge mittels Videomikroskopie dokumentieren. Für spezielle Anforderungen können wir die Zellen im Mikroskop auch unter Hypoxie und Hyperoxie Bedingungen wachsen lassen.
Isolierung und Anreicherung spezifischer Zelltypen mittels FACS
Das Labor der Gruppe Zellphysiologie und Zell Engineering unterhält ein 4 Laser FACS (fluorescent activated cell sorter) Gerät, welches die präzise Analyse von physikalischen oder chemischen Charakteristika von heterogenen Zellpopulationen ermöglicht. Mit Hilfe des FACS können wir seltene Zellarten innerhalb einer grossen Zellpopulation identifizieren (z.B. mesenchymale Stammzellen in Fettgewebe), immuno-genotypisieren von Zellen (z.B. spezifische periphere Leukozyten wie Gedächtnis B-Zellen), die Differenzierung von Zellen analysieren (z.B. die Differenzierung von Makrophagen zu Osteoklasten) oder subtile Veränderungen der zellulären Physiologie zu detektieren. Das FACS Gerät ist zusätzlich mit einem elektrostatischen Sortierungsmodul ausgerüstet, welches uns ermöglicht, dass wir aus einem komplexen Gemisch von Zellen eine spezifische Zellart anzureichern oder sogar einzelne Zellen direkt in eine 96 Well Platte zu sortieren um eine neue klonale Zellpopulation zu generieren.